热变性过程对于改善测序质量的研究
质粒DNA的热变性的作用
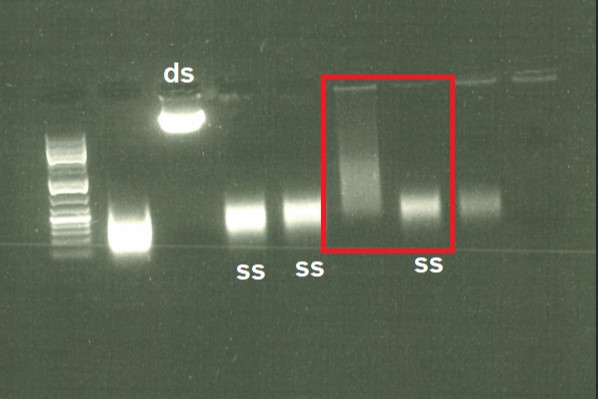
用于一代测序的模板应该是单链的DNA(ss DNA),质粒和PCR产物的DNA在开始测序PCR之前应该将两条链分开,传统做法会在加入测序酶之前,将模板放入TE缓冲液或者水中、85℃以上进行热变性得到单链的ssDNA,然后进行中和以及醇沉淀法得到模板。这个方法虽然有效,但是非常繁琐。检测变性后的核酸一般用1%的琼脂糖电泳来检测,在几乎所有的情况下,从dsDNA到ssDNA只是一部分,某些情况下还会形成额外的不可预测的条带。
改进后的热变性方法为将水或者TE缓冲液中的dsDNA于95℃以上的温度下变性5到20min,变性结束后插入碎冰中使其迅速降温到比较低的温度,得到可以用于测序的模板。检测变性后的核酸一般用1%的琼脂糖电泳来检测,得到的ssDNA质量明显提升。
通过多方面的实验结果可以明确的结论是,随着模板中的dsDNA的比值加大,测序质量有非常大的提升。
实验设计以及结果:
在pcr仪器上完成模板的变性实验,200ul的pcr反应管,20ul的反应体系,每个孔内有200ng的DNA在10mM tris-HCl PH8.0,0.01mM EDTA ,PH8.0缓冲环境中,将pcr仪预热到98℃,在规定的时间内取出反应管并且插入冰中,离心后将产物使用1%的琼脂糖凝胶进行分析(1XTAE、溴化乙锭,电泳1到2h),观察单链DNA与双链DNA的比值
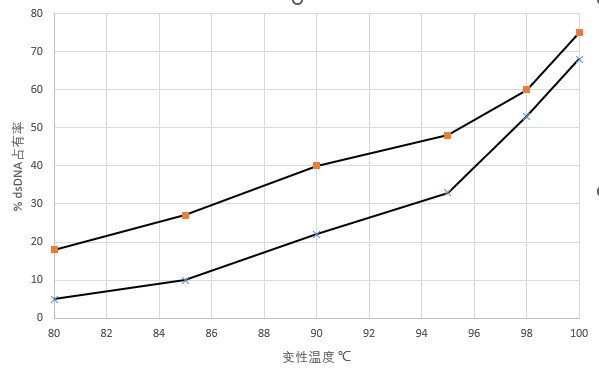
图1.1上图表示200ng的pGem3zf(3.2kbp;X)和pf2549(16kbbp,■)在PCR仪器上加热5min在设定的时间内的变性情况。
基因测序:
使用常规的测序方案,0.2ug的模板质粒和1到5uM的引物,2ul的测序酶MIX(1ul V1.8:3ul 5XSeq Buffer),使用10mM的trisHcl(ph8.0)或者水调节终体积10ul在PCR仪器上进行反应25个循环,(96℃ 10S、50℃ 5S、60℃ 4min)。使用去染料磁珠去除多余染料。使用3730XL测序仪进行测序。
质粒变性对温度的依耐性:
在温度低于80℃环境下,几乎没有dsDNA转变成ssDNA,图1.1显示了只有在90℃以上才会发生,通常我们选择的温度是98℃,温度的调整可以参考图1.1,
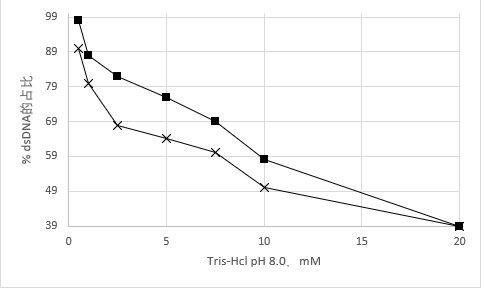
图1.2上图表示200ng的pGem3zf(3.2kbp;X)和pf2549(16kbbp,■)溶于Tris-Hcl中,在PCR仪器上加热5min,98℃。在不同的Buffer浓度中dsDNA所占比值。
质粒变性对缓冲液浓度的依耐性:
热变性过程中存在盐的浓度影响dsDNA到ssDna的转变的最佳浓度时间,图1.2显示了不同的质粒在0.5mM至20mM缓冲液浓度的变性实验,在5min时间内质粒转化效率0.5mM的是20mM的几乎2倍,根据实验,质粒在水中或者低于1mM Tris-Hcl大约是10mM中达到相同的变性效率所需的时间1/2.
不同大小质粒热变性的时间
将一系列的质粒大小范围是3到20kbp按照上述的方法在98℃进行热变性,每个质粒从dsDNA到ssDNA转化效率达到75%所花费的时间为横坐标,可以看出,从3.2kbp开始,每增加2.5kbp,变性时间需要从7.5分钟减去1分钟。可以表示为:
DT 75%(min)=7.5-(A-3.2)/2.5
选择75%是为了模板安全起见,因为过长的变性时间会导致模板链的断裂。
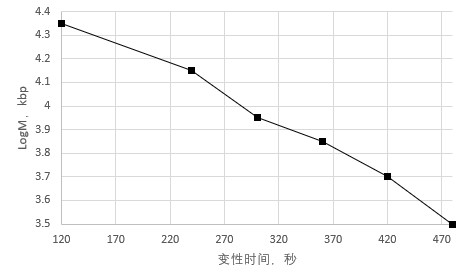
图 1.3 变性对温度的依赖。以不同分质量的质粒200ng,大小分别为3.2kbp、4.84kbp、7.25kbp、9.0kbp、14kbp、20.8kbp,dsDNA变性达到75%的时间。
1mM的EDTA会显著抑制dsDNA向ssDNA转变,达到5mM时就完全抑制dsDNA向ssDNA转变了,实验表明50mM的氯化钠和大于1mM的氯化镁也有类似的情况。
对于大小确定的时间,我们可以非常精确地测算变性所需要时间,然而在DNA测序实验室中却很少有人使用。实验室中通常使用的质粒大小为4到10kbp,每个大小使用不同的时间不切实际,因此我们建议使用的变性时间为3到5min。如果质粒保存在水中与保存在TE中,需要缩短几乎一倍的变性时间,DNA在水中的保存会有很多问题,比如形成额外的“非序列”的情况发生,长期保存在水中会导致质粒的质量大幅度下降。
一般来说,PCR片段以及线性DNA不需要热变性的步骤,但是短暂的变性可以提高测序的质量,变性的时间可以参考质粒的数据。当序列中存在复杂结构如超高GC含量、高CTT含量时,在做变性实验时,ds向ss转变所需的时间大约要20min,我们仍在对类似的现象做研究。
质粒的热变性的好处
1. 获得最佳读长所需要的DNA量减少,在此过程中,几乎所有的超螺旋和线性化质粒都变成可以进行测序的ssDNA,这个实验也测试了3到20kbp的质粒,均得到类似的结果。
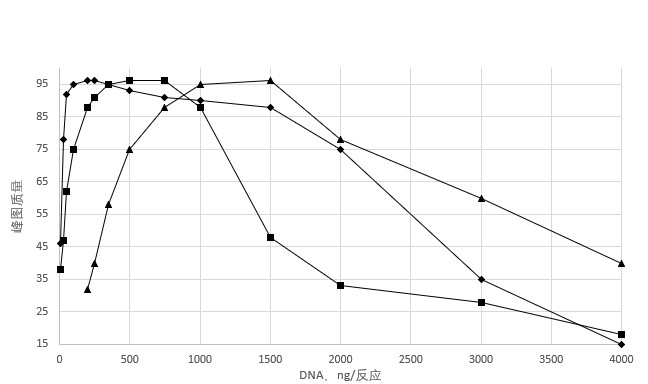
图1.4 使用质粒的热变性获得有效读长,使用pGem3zf进行标准测序的浓度范围以△表示,进行热变性方案使用□和◇表示。
2. 一些困难模板,这个或许是唯一的方法。例如使用标准方案来做测序,测序结果没有信号,使用了热变性方案得到较好的信号以及读长。
3. 热变性方法能够很好的解决高GC结构的。我们做过极端的测试,当GC含量高大90%,也可以得到较好的结果。一些困难模板的一次与通过率可以达到90%左右。
4. 使用热变性方法可以得到更加稳定以及信号均一的读长。
5. 可以显著的降低循环的数量。通常质粒的扩增循环由原先的30到35个循环减少到25个左右。
PCR产物的热变性研究
我们也做了基于PCR产物的热变性的研究,,热变性后的PCR产物用于测序效果也有了明显的提升,相比于质粒,热变性的时间以及温度可以稍作调整。
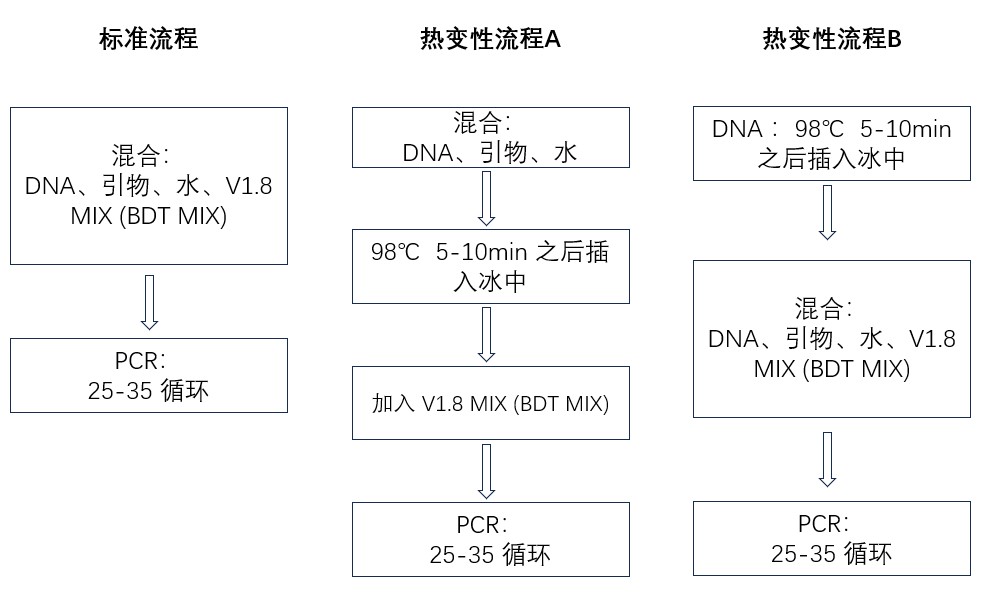
用于一代基因测序热变性的操作流程
相比于传统的一代测序的操作,加入热变性步骤主要有如下两种方法,可以根据使用的方便程度以及实验的效果调整。